L
1. Spectres d'émission
1.1. Spectres continus d'origine thermique
Un corps chauffé émet de la lumière. Cette lumière peut être dispersée par un prisme afin d'observer son spectre.
Le spectre obtenu est appelé spectre d'émission.
Quelle relation existe-t-il entre la température d'un corps chauffé et la lumière qu'il émet ?
Lorsque le filament d'une lampe à incandescence est porté à haute température, ce dernier émet de la lumière. Si on diminue l'intensité du courant électrique qui traverse le filament, sa température diminue et la lumière émise devient rouge orangé. Les vidéos suivantes montrent, d'une part l'influence de la température du filament sur la lumière, et, d'autre part, l'influence de la température du filament sur le spectre émis.
Vidéo 1 Vidéo 2
Un corps chaud émet un rayonnement qui dépend de sa température. Le spectre obtenu est un spectre d'émission, continu, d'origine thermique.
Relation entre température et longueur d'onde :
Les vidéos suivantes montrent la relation entre la température d'un corps chauffé et l'intensité des différentes radiations composant le spectre.
Vidéo 3 Vidéo 4
La relation entre la température d'un corps et le spectre qu'il émet constitue la loi de Wien :
λm´ T = A
λm : longueur d'onde présentant le maximum d'intensité exprimée en μm
T : température du corps exprimés en Kelvin (K).
A : constante dont la valeur est 2900 μm.K
Le Kelvin est l'unité de l'échelle absolue de température : T(K) = θ (°C) + 273,15
La longueur d'onde présentant le maximum d'intensité dépend de la température du corps. Cette dépendance constitue le rayonnement du corps noir de Planck, comme le montre l'animation ci-dessous.
Plus la température d'un corps est élevée, plus son spectre s'enrichit de radiations de courtes longueurs d'onde.
Glisser sur l'image pour visualiser le spectre continu de la lumière émise par le filament de la lampe à une température supérieure.
1.2. Spectres de raies
Un gaz à basse pression et à température élevée émet de la lumière. Cette lumière dispersé par un prisme fait apparaître un spectre constitué d'un nombre restreint de radiations, comme le montre la photographie ci-dessous.
Glisser sur l'image pour voir le spectre obtenu à l'aide d'une lampe à vapeur de mercure et d'une lampe à hydrogène.
Le spectre obtenu est un spectre d'émission de raies.
Chaque élément chimique possède un spectre caractéristique. Il constitue la carte d'identité de l'élément chimique.
Cliquer ici pour voir le spectre d'émission des différents éléments chimiques de la classification périodique.
L'analyse d'un spectre de raies permet donc d'identifier une entité chimique.
2. Spectres d'absorption
Lorsque
la lumière blanche traverse un milieu transparent et coloré, elle devient
colorée. Le milieu coloré a privé la lumière d'une partie de son rayonnement
initial.
Le spectre obtenu est un spectre d'absorption dont l'analyse va permettre d'étudier le milieu traversé.
2.1. Spectres de bandes

Un faisceau de lumière blanche passe à travers une cuve contenant une solution violette de permanganate de potassium.
On observe sur l'écran une tache violette.
Si on place un prisme sur le trajet de cette lumière colorée, on obtient un spectre pour lequel une plage de longueurs d'onde est absente.

Le spectre a) correspond au spectre de la lumière blanche avant la traversée de la solution. C'est un spectre d'émission continu.
Le spectre b) correspond au spectre de la lumière blanche après la traversée de la solution de permanganate de potassium. Il présente une bande noire correspondant à l'absorption de certaines radiations par la solution.
Les radiations non absorbées (essentiellement les radiations rouges, bleues et violettes) donnent à la solution sa couleur violette.
Le spectre b) est un spectre d'absorption de bandes.
2.2. Spectres de raies
Lorsque la lumière blanche traverse la vapeur d'un élément chimique, le spectre obtenu présente un fond continu sur lequel apparaissent des raies noires. Ces raies noires correspondent à des radiations manquantes absorbées par le gaz.
Le spectre obtenu est un spectre d'absorption de raies, comme le montre le spectre ci-dessous.

spectre d'absorption du sodium
L'analyse des radiations absorbées montre qu'elles ont les mêmes longueurs d'onde que celles qui sont émises par l'élément chimique quand il est porté à haute température.

spectre d'émission du sodium
Un atome ou ion monoatomique en phase gazeuse ne peut absorber que les radiations qu'il est capable d'émettre.
Cliquer ici pour visualiser les spectres d'émission et d'absorption des éléments chimiques de la classification périodique.
3. Astrophysique
3.1. Structure du Soleil
Le Soleil est, depuis sa naissance, est le siège de transformations libérant une énergie considérable. Au coeur du Soleil, la température atteint 10 millions de degrés Celsius. A la surface, la photosphère, la température n'est plus que de l'ordre de 6000 °C. C'est cette échauffement qui est à l'origine de la lumière solaire.

Cette lumière peut être analysée pour permettre de savoir, d'une part, la température de surface du Soleil, et d'autre part, la composition chimique de la photosphère.
Le spectre du Soleil présente un fond continu sur lequel apparaissent des raies noires correspondant aux radiations absorbées par les différents éléments chimiques de la photosphère.
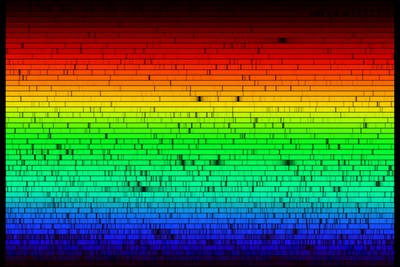
Joseph von Fraunhofer (1787-1826) découvrit ces raies (appelées raies de Fraunhofer) et en déduisit la composition chimique du Soleil. Puis il observa d'autres astres comme Vénus, par exemple.
3.2. Les autres étoiles
La spectroscopie, c'est-à-dire, l'étude des spectres des étoiles permet d'avoir des informations sur leur température et leur composition chimique.
Ainsi les étoiles les plus chaudes apparaissent bleues dans le ciel alors que les étoiles plus froides apparaissent plutôt rouges.
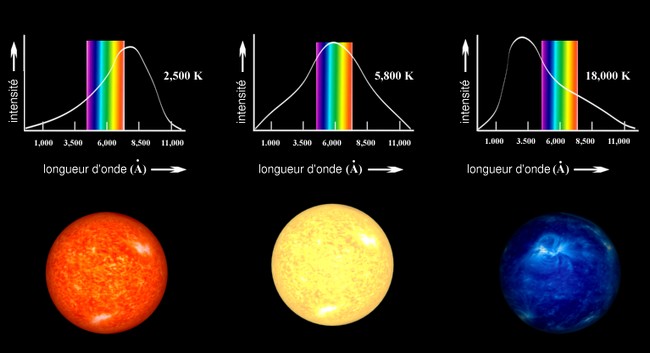
Les photographies ci-dessous montrent Bételgeuse, étoile froide dont la température est de l'ordre de 2400 K, et Véga, étoile plus chaude dont la température est de l'ordre de 9600 K. Bételgeuse apparaît rouge alors que Véga apparaît bleue.


Etoile Bételgeuse Etoile Véga
Les étoiles sont classées suivant leur température et leur luminosité, en différentes classes, selon le diagramme d'Hertzsprung-Russel (diagramme HR). Les différentes spectroscopies permettent de suivre ainsi l'évolution des étoiles.
Cliquer sur l'image pour suivre l'évolution d'une étoile au sein du diagramme HR.