Pour visualiser les molécules de ce chapitre dans votre navigateur, vous devez installer le module complémentaire MDLChime téléchargeable dans la page LOGICIELS.
1. Règles de stabilité des éléments chimiques
1.1. Stabilité des gaz rares
Hélium, Néon et Argon sont des gaz appelés gaz rares ou nobles. Il existent à l'état monoatomique. Ces gaz sont inertes chimiquement. On dit aussi qu'ils sont stables car ils ne cherchent pas à réagir avec d'autres espèces chimiques.
L'hélium est un gaz incolore, inodore et non toxique.
Symbole :

Numéro atomique : Z = 2
Structure électronique : (K)2
Cliquer sur l'image pour voir le remplissage des couches électronique de l'atome d'hélium.
Le néon est un gaz donnant une lueur rougeâtre lorsqu'il est utilisé dans les tubes à vide.
Symbole :

Numéro atomique : Z = 10
Structure électronique : (K)2 (L)8
Cliquer sur l'image pour voir le remplissage des couches électronique de l'atome de néon.
L'Argon est un gaz faisant partie des constituants de l'atmosphère terrestre. Il est utilisé dans les lampes à incandescence pour protéger le filament.
Symbole :

Numéro atomique : Z = 18
Structure électronique : (K)2 (L)8 (M)8
Cliquer sur l'image pour voir le remplissage des couches électronique de l'atome d'argon.
La structure électronique de ces trois éléments He, Ne et Ar montre que leur couche externe est saturée. C'est pourquoi ces éléments sont inertes chimiquement et sont donc stables.
1.2. Règles du duet et de l'octet
Tous les éléments en dehors des gaz rares ne sont pas stables. Pour augmenter leur stabilité, les éléments vont chercher à adopter la structure électronique des gaz rares les plus proches.
Règle du duet : les éléments vont chercher à adopter la structure électronique de l'hélium, (K)2.
Règle de l'octet : les éléments vont chercher à adopter la structure électronique
- du néon, (K)2 (L)8,
- ou de l'argon (K)2 (L)8 (M)8 .
Pour cela, les éléments vont :
- perdre ou gagner un ou plusieurs électrons et former des composés ioniques
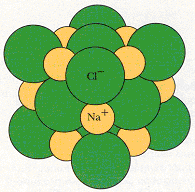
cristal de chlorure de sodium NaCl
- partager leurs électrons externes et former des molécules.
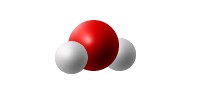
molécule d'eau H2O
2. Formation des molécules
2.1. Les molécules
Une molécule est un regroupement d'atome liés entre eux. Une molécule est électriquement neutre.
Exemples :
|
Nom |
eau | dioxygène | butane |
|
Modèle |
 |
 |
 |
|
Formule brute |
H20 |
02 |
C4H10 |
|
Visualisation 3D |
|
2.2. La liaison covalente
Une liaison covalente entre deux atomes est constituée de deux électrons mis en commun par chacun des atomes. Au cours de la formation de la liaison, les atomes se rapprochent et il y a recouvrement de leur nuage électronique. Les électrons appartiennent alors à chaque atome de la liaison.
Dans une molécule, chaque atome possède une structure en octet, sauf pour l'atome d'hydrogène qui possède une structure en duet.
La vidéo suivante simule la formation de la liaison entre les deux atomes d'hydrogène de la molécule de dihydrogène H2.
Les deux électrons mis en commun constituent un doublet d'électrons. On distingue :
- les doublets liants : ils participent à la liaison entre deux atomes, on les représente par un simple trait entre les deux atomes
Exemple : formule de Lewis de la molécule de méthane (4 doublets liants)
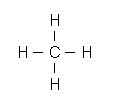
- les doublets non liants : ils ne participent pas à la liaison chimique, on les représente par un trait à côté de l'atome.
Exemple : formule de Lewis de la molécule d'ammoniac (3 doublets liants et 1 doublet non liant)

3. Représentation de Lewis des molécules
3.1. Protocole de mise en place de la représentation de Lewis
La formule brute d'une molécule donne le type et le nombre d'atomes. La formule de Lewis montre la façon dont sont liés les atomes ainsi que tous les électrons externes de la molécule.
3.2. Les différentes liaisons
3.2.1. La liaison simple
Lorsque deux atomes d'une molécule partagent un électron pour former une liaison covalente, la liaison est dite simple.
| Atome | C | H | H | H | H |
| Numéro atomique Z | 6 | 1 | 1 | 1 | 1 |
| Structure électronique | (K)2 (L)4 | (K)1 | (K)1 | (K)1 | (K)1 |
| Nombre de liaison | 4 | 1 | 1 | 1 | 1 |
| Nombre d'électrons externes | 4 | 1 | 1 | 1 | 1 |
| Nombre total d'électrons externes | 8 | ||||
| Nombre de doublets | 4 | ||||
La molécule possède 4 doublets liants et aucun doublet non liant.

| Atome | N | H | H | H |
| Numéro atomique Z | 7 | 1 | 1 | 1 |
| Structure électronique | (K)2 (L)5 | (K)1 | (K)1 | (K)1 |
| Nombre de liaison | 3 | 1 | 1 | 1 |
| Nombre d'électrons externes | 5 | 1 | 1 | 1 |
| Nombre total d'électrons externes | 8 | |||
| Nombre de doublets | 4 | |||
La molécule possède 3 doublets liants et 1 doublet non liant.

| Atome | O | H | H |
| Numéro atomique Z | 8 | 1 | 1 |
| Structure électronique | (K)2 (L)6 | (K)1 | (K)1 |
| Nombre de liaison | 2 | 1 | 1 |
| Nombre d'électrons externes | 6 | 1 | 1 |
| Nombre total d'électrons externes | 8 | ||
| Nombre de doublets | 4 | ||
La molécule possède 2 doublets liants et 2 doublets non liants.

3.2.2. La liaison double
Lorsque deux atomes d'une molécule partagent deux électrons chacun pour former une liaison covalente, la liaison est dite double.
| Atome | O | O |
| Numéro atomique Z | 8 | 8 |
| Structure électronique | (K)2 (L)6 | (K)2 (L)6 |
| Nombre de liaison | 2 | 2 |
| Nombre d'électrons externes | 6 | 6 |
| Nombre total d'électrons externes | 12 | |
| Nombre de doublets | 6 | |
La molécule possède 2 doublets liants et 4 doublets non liants.
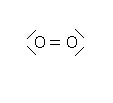
| Atome | C | O | O |
| Numéro atomique Z | 6 | 8 | 8 |
| Structure électronique | (K)2 (L)4 | (K)2 (L)6 | (K)2 (L)6 |
| Nombre de liaison | 4 | 2 | 2 |
| Nombre d'électrons externes | 4 | 6 | 6 |
| Nombre total d'électrons externes | 16 | ||
| Nombre de doublets | 8 | ||
La molécule possède 4 doublets liants et 4 doublets non liants.
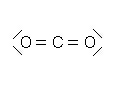
3.2.3. La liaison triple
Lorsque deux atomes d'une molécule partagent trois électrons chacun pour former une liaison covalente, la liaison est dite triple.
| Atome | N | N |
| Numéro atomique Z | 7 | 7 |
| Structure électronique | (K)2 (L)5 | (K)2 (L)5 |
| Nombre de liaison | 3 | 3 |
| Nombre d'électrons externes | 5 | 5 |
| Nombre total d'électrons externes | 10 | |
| Nombre de doublets | 5 | |
La molécule possède 3 doublets liants et 2 doublets non liants.
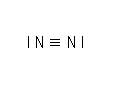
| Atome | C | N | H |
| Numéro atomique Z | 6 | 7 | 1 |
| Structure électronique | (K)2 (L)4 | (K)2 (L)5 | (K)1 |
| Nombre de liaison | 4 | 3 | 1 |
| Nombre d'électrons externes | 4 | 5 | 1 |
| Nombre total d'électrons externes | 10 | ||
| Nombre de doublets | 5 | ||
La molécule possède 4 doublets liants et 1 doublets non liant.
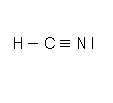 .
.
4. Isomères
Deux molécules répondant à la même formule brute mais possédant des formules de Lewis différentes sont appelées isomères. Les atomes qui les constituent sont agencés différemment les uns par rapport aux autres.
Il existe deux isomères de la molécule répondant à la formule brute C2H7N :
|
|
|
|
|
|
Le pentane de formule brute C5H12 possède trois isomères.
| Pentane | 2-Méthylbutane | 2,2-Diméthylpropane |
|
|
|
|
5. Géométrie des molécules
5.1. Modèle de Gillepsie
Une molécule composée d'un atome central autour duquel sont disposés les autres atomes adopte une géométrie particulière.
Cette géométrie résulte de la répulsion entre tous les doublets liants et non liants de la molécule. Le modèle de Gillepsie montre que ce type de molécule adopte une géométrie tétraédrique afin de limiter au maximum ces répulsions.
La figure suivante montre la répartition des quatre doublets électroniques autour d'un atome central A.
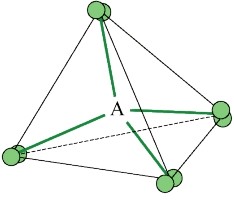
Les doublets de la molécule s'organisent autour de l'atome A en adoptant une géométrie tétraédrique de façon à limiter les répulsions.
Le tableau ci-dessous rassemble les caractéristiques des molécule de méthane, d'ammoniac et d'eau.
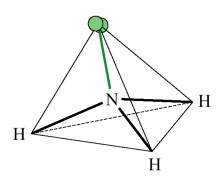
| Formule brute | CH4 | NH3 | H2O |
| Représentation | 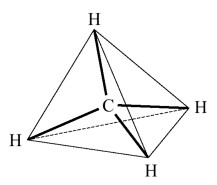 |
 |
 |
| Description | Les 4 liaisons C-H occupent les quatre positions du tétraèdre |
Les 3 liaisons N-H occupent trois des quatre positions du tétraèdre et forment une pyramide |
Les 2 liaisons O-H occupent deux des quatre positions du tétraèdre et forment un coude |
| Géométrie | tétraédrique | pyramidale | coudée |
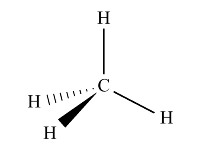
5.1. Représentation de Cram
L'animation ci-dessous permet de visualiser l'écriture d'une molécule tridimensionnelle dans un plan.
Conventions de la représentation de Cram :

La représentation de Cram de la molécule de méthane est :