
Aujourd'hui, on peut «regarder» les atomes et les manipuler.


Cliquer ici pour comprendre le principe du microscope à effet tunnel.
On est loin du modèle des atomes «crochus» de la Grèce Antique.
1. Histoire du modèle atomique
1.1. Une brève histoire
Voici les grands personnages qui ont marqué l'histoire du modèle de l'atome :
Glisser sur leur portrait pour connaître leur contribution et découvrir leur modèle atomique.
C'est l'expérience de Rutherford qui a permis de déterminer la structure lacunaire de la matière. Cliquer ici pour la découvrir.
1.2. Les atomes aujourd'hui

Erwin Schrödinger (1887 - 1961) est l'un pionniers d'une nouvelle physique : la physique quantique.
Il a permis le développement du formalisme théorique de la mécanique quantique par sa célèbre équation : l'équation de Schrödinger, pour laquelle il a reçu le prix Nobel en 1933.
Le résultat est que l'atome est constitué d'un noyau et d'électrons qui ne sont plus localisables. On parle alors de probabilité de présence.
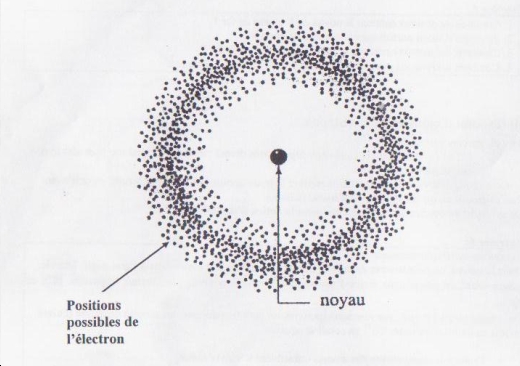

En 1932, le physicien anglais Chadwick (1891-1974) découvre, dans le noyau, une particule : le neutron, électriquement neutre.
Le noyau est donc composé de protons (chargés positivement) et de neutrons.
Cliquer ici pour voir les différents modèles de l'atome au cours de l'histoire.
2. Description de l'atome
2.1. Le noyau
Le noyau de l'atome est constitué d'un ensemble de particules appelées nucléons. On distingue les protons et les neutrons. Il est chargé positivement.
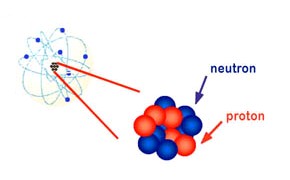
Le tableau ci-dessous rassemble les caractéristiques des nucléons.
| nucléon | proton | neutron |
| masse (kg) | mp = 1,673. 10-27 | mn = 1,675. 10-27 |
| charge (C) | e | 0 |
e est appelé charge élémentaire : e = 1,6. 10-19 C (Coulomb)
Le nombre de protons est appelé Z : c'est le nombre de charge ou numéro atomique de l'atome.
Le nombre de neutrons est appelé N.
Le nombre de nucléons est appelé A : A = Z + N.
2.2. Les électrons
Les électrons sont des particules chargées négativement. Ils sont beaucoup plus petits et légers que les nucléons.
Caractéristique de l'électron :
- masse : me = 9,1. 10-31 kg
- charge : -e = - 1,6. 10-19 C
Un atome est électriquement neutre. Il y a donc autant d'électrons que de protons.
2.3. Symbole de l'atome
Pour représenter les atomes, on utilise des symboles (une ou deux lettres en général) affectés des nombres A et Z selon le schéma ci-dessous.

X : nom de l'atome
A : nombre de nucléons
Z : numéro atomique
Cette représentation permet de déterminer la composition de l'atome. Cliquer ici pour découvrir l'ensemble des atomes de la classification périodique ainsi que leur composition.
2.4. Dimensions de l'atome
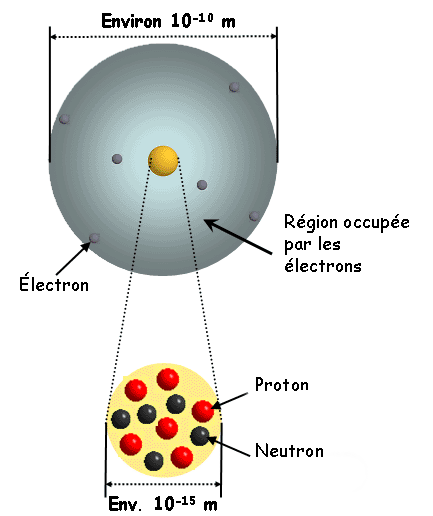
L'ordre de grandeur de la dimension des atomes est 10-10 m.
L'ordre de grandeur de la dimension de leur noyau est 10-15m.
Le noyau de l'atome est environ 100 000 fois plus petit que l'atome lui-même. Le volume occupé par le noyau est considérablement plus petit que celui occupé par l'atome.
La structure lacunaire de l'atome et la faible masse des électrons montre que l'essentiel de la matière qui constitue l'atome est concentrée dans son noyau.
2.5. Masse de l'atome
L'atome est constitué de protons, de neutrons et d'électrons. La masse de l'atome est donc la somme des masses de ses constituants.

La masse des électrons est négligeable devant celle des nucléons. La masse des protons est sensiblement identique à celle des neutrons.
On peut donc écrire :

La masse de l'atome est pratiquement égale à la masse de ses nucléons :
matome ≈ A ´ mnucléon
avec mnucléon = 1,67. 10-27 kg
3. Eléments chimiques
3.1. Isotopes
Les isotopes sont des atomes dont le noyau possède le même nombre de protons mais des nombres de neutrons différents. Leur masse est donc différente.
Le tableau ci-dessous rassemble les caractéristiques des isotopes de l'hydrogène.
| isotope | hydrogène | deutérium | tritium |
| modèle |
 |
 |
 |
| nombre de protons | 1 | 1 | 1 |
| nombre de neutrons | 0 | 1 | 2 |
| nombre d'électrons | 1 | 1 | 1 |
3.2. Ions monoatomiques
L'atome est électriquement neutre : il comporte autant de protons que d'électrons.
Dans certaines conditions, l'atome peut perdre ou gagner un ou plusieurs électrons. Il forme alors un ion monoatomique. On distingue alors :
- les cations : ions positifs issus d'atomes ayant perdu un ou plusieurs électrons.
ex : H+, Na+, Cu2+
- les anions : ions négatifs issus d'atomes ayant gagné un ou plusieurs électrons.
ex : F-, Cl-, O2-
L'animation ci-dessous montre la formation de l'ion sodium à partir de l'atome de sodium.
3.3. Eléments chimiques
On appelle élément chimique l'ensemble des entités chimiques possédant le même numéro atomique.
Exemple :
L'atome d'hydrogène possède 1 proton.
Le deutérium, isotope de l'hydrogène, possède 1 proton.
L'ion H+, issu de l'atome d'hydrogène, possède 1 proton.
Ces trois entités chimiques ont le même nombre de protons. Il sont constitués du même élément chimique de numéro atomique Z = 1, appelé Hydrogène.
Il existe plus d'une centaine d'éléments chimiques qui sont rassemblés dans le tableau périodique des éléments.

4. Le cortège électronique
4.1. Couches électroniques
Les électrons d'un atome s'organisent de manière particulière. Ils se répartissent en couches électroniques qui constituent le nuage électronique.
Pour les éléments de numéro atomique inférieur ou égal à 18, les électrons se répartissent en 3 couches dont les caractéristiques sont les suivantes.
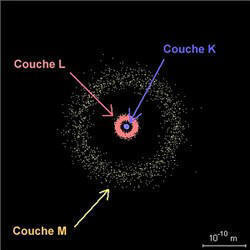
| numéro n de la couche | nom de la couche | éloignement du noyau | nombre maximum d'électrons par couche |
| 1 | K | proche | 2 |
| 2 | L | relativement éloignée | 8 |
| 3 | M | très éloignée | 18 |
Le nombre maximal d'électrons par couche obéit à la formule : nmax = 2n2
Les électrons se répartissent en respectant l'ordre K, L et M des couches électroniques. La couche externe correspond à la dernière couche remplie. Lorsqu'elle possède le nombre maximal d'électrons, la couche externe est saturée.
4.2. Structure électronique de l'atome
La structure électronique d'un atome est la répartition de ses électrons sur les couches K, L et M en respectant l'ordre de remplissage.
Cliquer ici pour voir le remplissage des couches électroniques de l'atome de silicium.
L'animation ci-dessous présente le nuage électronique et la structure électronique des dix-huit premiers éléments du tableau périodique.